Autoridades de EU recomiendan la venta de pruebas 'caseras' de VIH
Los consumidores probablemente pronto podrán realizarse ellos mismos una prueba de VIH y rápidamente conocer los resultados en la privacidad de su casa después que se aprobó esta recomendación de forma unánime por el comité asesor de la Dirección de Alimentos y Medicamentos de Estados Unidos (FDA por sus siglas en inglés) el pasado martes.
El panel dijo que la prueba casera para VIH OraQuick debería estar disponible como los medicamentos de autoservicio (OTC por sus siglas en inglés) ya que, aseguran, su uso es seguro y efectivo y los beneficios superan por mucho a los posibles riesgos.
De ser aprobado por la FDA, esta prueba sería la primera prueba OTC en llevar la etiqueta de estar indicada para VIH o cualquier enfermedad infecciosa. Las recomendaciones que da el comité asesor de la FDA no son obligatorias, pero generalmente se siguen.
Se estima que 1.2 millones de estadounidenses viven con VIH, de acuerdo con el Centro de Control y Prevención de Enfermedades . Una de cada cinco personas desconoce que vive con VIH. Y cerca de 50,000 nuevos casos de VIH se reportan cada año.
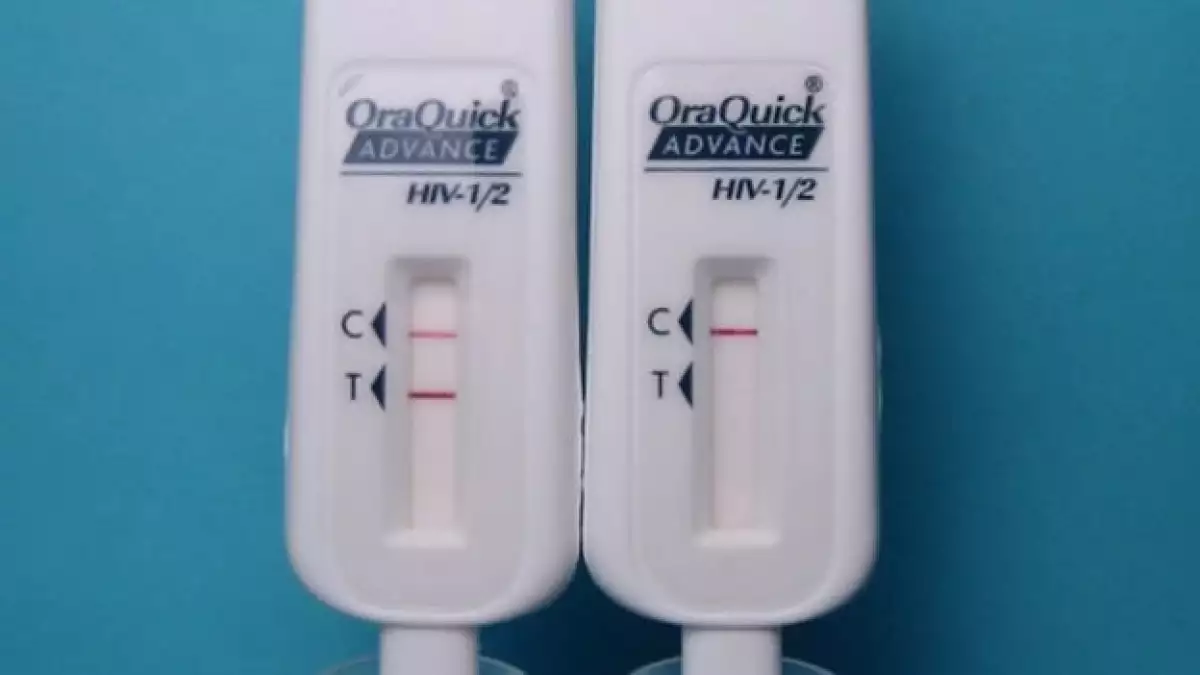
OraSure Technologies, Inc., compañía que fabrica esta prueba, también fabrica la ya aprobada prueba rápida de anticuerpos VIH 1/2 OraQuick Advanced.
La prueba sólo puede aplicarse dentro de un entorno clínico y los resultados se obtienen en 20 minutos. La prueba casera es una versión modificada dónde el individuo toma una muestra de las encías superior e inferior con un dispositivo que cuenta con unas almohadillas. Después el dispositivo se inserta en una solución vial. Muy parecido a una prueba de embarazo casera, si aparece una línea indica que el resultado es negativo, dos líneas significa que el resultado es positivo.
El kit incluye instrucciones paso a paso que indican cuando aplicar la prueba, como preparar y manejar la prueba y cómo interpretar los resultados de la prueba. La compañía también provee información sobre cómo dar seguimiento a los resultados a través del Centro de Respuestas de OraQuick para obtener apoyo y referencias médicas locales. El centro opera 24 horas los 7 días de la semana.
"La prueba está diseñada para ser comprensible dentro de un amplio rango de niveles de educación", dijo Stephan Lee, vicepresidente ejecutivo y director científico de OraSure. "Nos permite tener una amplia variedad de ambientes donde aplicar la prueba".
De acuerdo con Lee, la prueba tiene un alto grado de precisión con un 93% de sensibilidad. En estudios clínicos, la prueba tuvo una precisión de 99.98% de efectividad para determinar quién no era portador del virus. Los panelistas estaban preocupados sobre cómo asegurarse que el empaque tuviera un lenguaje comprensible para el público para explicar que significaba el periodo de ventana. Específicamente se debe esperar a que transcurran 3 meses a partir de que ocurrieran los comportamientos de riesgo para poder hacer la prueba. Otra gran preocupación era el riesgo de obtener falsos positivos y falsos negativos.
Pero para los cerca de 25 profesionales de la salud y de los que pugnan sobre el VIH/Sida y que se dirigieron al panel implorando la aprobación por parte del comité, esos riesgos no son más importantes que la oportunidad de ampliar la oportunidad de tener pruebas de acceso público y de reducir el número de transmisiones al asegurarse que la gente tenga conocimiento si es que está viviendo con VIH. Que una prueba pueda llevarse a cabo en la privacidad del hogar se tomó como un beneficio adicional, además de ser una manera de contrarrestar el estigma que rodea al VIH. Nadie solicitó que la prueba no fuera aprobada.
"Necesitamos hacer lo que sea necesario para cambiar el número de personas que desconocen si son portadoras o no", dijo Whitney Cordova de la Fundación Cuidados de Salud del SIDA . "Esta prueba nos va a ayudar en ese tema. Lo perfecto no puede ser enemigo de lo bueno".
"Está claro que una prueba OTC no es la prueba ideal para todos los casos", dijo Tom Donohue Jr, Fundador de Quién es Positivo . "Los OTC son otra herramienta. Los OTC tienen el potencial de alcanzar a un número mucho más amplio de individuos que desean saber si viven con VIH bajo sus propios términos. Es momento que todos conozcan si son o no portadores. Es momento de darle a la gente las herramientas para poder saber si son portadores o no".
Si la prueba casera para VIH OraQuick obtiene la aprobación final por parte de la FDA, las esperanzas crecen sobre que la prueba se convertiría en un instrumento que ayudaría a reducir las tasas de transmisión en Estados Unidos y a nivel global.
Hay "1.2 millones de personas en Estados Unidos que viven con VIH/Sida, y 20% de ellos lo desconoce. Esta es una bomba de tiempo", dijo Frank Oldham, presidente y director general de la Asociación Nacional de Personas con Sida. "Necesitamos más armas para reducir la transmisión de VIH y estamos moralmente obligados de traer estas pruebas al mercado y así reducir los contagios".
Cornelious Baker, asesor técnico para FHI360 Centro de Salud Comunitaria y SIDA , subrayó la importancia de poder realizar pruebas de detección en casa y obtener resultados rápidos.
"Esto es especialmente importante para todos aquellos que no buscarían hacerse una prueba en un lugar público o que les resultaría más cómodo hacerse una prueba casera por alguna situación geográfica o de tiempo y así poder estarse checando frecuentemente con este nuevo método", Baker dijo. "Si vamos a ganar esta batalla contra la epidemia del VIH, necesitamos implementar múltiples estrategias. Aunque este es un producto que no todo el mundo utilizará o necesita, esta prueba casera es una contribución más para ayudar a cada estadounidense a formar parte de la erradicación del Sida en Estados Unidos".
Los presentadores de la FDA claramente sintieron que la prueba tiene su mérito.
"Mayores accesos a pruebas potencialmente lograran que más personas conozcan si es que viven con VIH", dijo el médico Eliot Cowan, quien habló a nombre de la FDA. "Aparentemente hay un beneficio al incrementar el número de personas que estén consientes si viven o no con VIH. Hay un impacto dentro de la salud pública además de un impacto en la salud individual".
Los ejecutivos de OraSure parecen confiados en que obtendrán la aprobación, y llamarán a ese día un día trascendental para la salud pública. "Planeamos trabajar en conjunto con la FDA en los siguientes meses para refinar y hacer mejoras en la etiqueta del producto", dijo Douglas Michels, presidente y director de la compañía. "Y tan pronto como podamos llevar eso a cabo, tan pronto nos será posible poner el producto en manos de los vendedores minoristas".
Michael dice que aún no han concluido con el tema del precio, pero se les venderán la prueba a los minoristas con un descuento y, al final, serán los minoristas quiénes determinarán el precio al público.